PBL 6 REACCIONES QUÍMICAS
Definición reacción química: Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más especies químicas o sustancias, se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos.
Tipos de reacciones químicas
- REACCIONES DE SÍNTESIS O ADICIÓN: En estas reacciones químicas dos o más sustancias (reactivos) se combinan para formar otra sustancia (producto) más compleja. Un ejemplo cotidiano es el amoniaco, que se forma mediante una reacción de síntesis entre el nitrógeno y el hidrógeno
- REACCIONES DE DESCOMPOSICIÓN: Al contrario que en las reacciones químicas de síntesis, en las de descomposición un compuesto químico se divide en sustancias más simples. Agua oxigenada: 2 H2O2 (l) → 2 H2O (l) + O2 (g)
- REACCIONES DE DESPLAZAMIENTO, SUSTITUCIÓN O INTERCAMBIO: En este tipo de reacción química, se reemplazan los elementos de los compuestos. Puede tratarse de reacciones simples (un elemento desplaza a otro) o dobles (se intercambian elementos). En ambos, casos el resultado es la formación de nuevos compuestos químicos. 2 Fe2O3 + 3 C → Fe + CO2
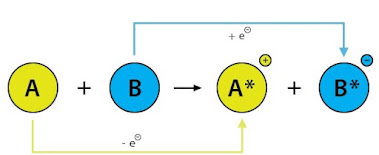
- REACCIONES REDOX O DE OXIDACIÓN-REDUCCIÓN: La principal característica de las reacciones redox es que hay un intercambio de electrones. Uno de los compuestos pierde electrones mientras que el otro los gana. Decimos que el compuesto que pierde electrones se oxida y el que los gana se reduce.
- REACCIONES DE COMBUSTIÓN: En realidad la combustión es un tipo de reacción redox. La diferenciamos porque en el caso de las reacciones de combustión la oxidación se realiza de forma extremadamente rápida y potente. Para que ocurra, un material combustible se combina con el oxígeno y se desprende energía, normalmente calorífica y lumínica.
- REACCIONES ÁCIDO-BASE: Este tipo de reacción química una sustancia básica y otra ácida se neutralizan entre ellas. Como resultado, se forma un compuesto neutro y agua. Como ejemplo, cuando el ácido clorhídrico reacciona con el hidróxido de sodio se produce sal (cloruro de sodio) y agua.
Practica 1
Material: 2 vasos de precipitados, papel tornasol, ácido y reactivo básico, pinzas, matraz Erlenmeyer, Fenolftaleína (Indicador de pH).
Reactivos:
- ÁCIDO SULFÚRICO (10ml)
- CLORURO DE SODIO (10ml)
Escala de Ph:
Parte A
Tomamos una muestra (10cm3) de NaOH (Hidróxido sódico) y una muestra (10cm3) de H2SO4 (Ácido sulfúrico) en el otro vaso de precipitados
Con las pinzas, introducimos el papel de tornasol en cada unos de los vasos de precipitados. Aquel compuesto que actúa como ácido, hará que el tornasol se tiña de rojo, mientras que aquel que actúa como base, hará qu el tornasol se tiña de azul.






























La conclusión de la reacción de la lluvia de oro no esta completa. No habéis especificado que la primera practica es de detección acido/base y la otra de neutralización y tampoco decís que es neutralizar.
ResponderEliminar